Химические классы пестицидов
Оглавление
- Химические и физические свойства
- Действие на вредные организмы
- Гербициды
- Механизм действия
- Резистентность
- Профилактика резистентности
- Репелленты
- Применение
- Токсикологические свойства и характеристики
- Класс опасности
- Получение
Химические и физические свойства
Аминопиридины (моноаминопиридины, пиридинамины) являются частью химического класса пиридины. Подробнее о пиридине и производных пиридина – в статье "Пиридины".
Аминопиридины – бесцветные кристаллические вещества, легко растворимые в воде, этаноле, диэтиловом эфире и многих других органических растворителях, труднорастворимые в лигроине[2].
В зависимости от положения аминогруппы в пиридиновом цикле различают α-аминопиридин (2-аминопиридин, 2-пиридинамин), β-аминопиридин (3-аминопиридин, 3-пиридинамин) и γ‑аминопиридин (4-аминопиридин, 4-пиридинамин). Эти соединения являются первыми для класса аминопиридины[5].
Температура плавления α-аминопиридина – 58ºC, β-аминопиридина – 64 ºC; γ‑аминопиридин – 159º C[5].
Аминопиридины являются более сильными основаниями, чем пиридин и анилин, поскольку содержат в составе два основных цента – атом азота пиридинового кольца и атом азота аминогруппы. Одновременно α- и γ-аминопиримидины, в отличии от β-аминопиримидина способны образовывать соли только с одним эквивалентом минеральной кислоты (по гетероатомому). Это объясняется расположением аминогруппы. В молекулах α- и γ-аминопиримидинов аминогруппа сопряжена с гетероатомом и утрачивает основные свойства, выполняя функцию делокализации положительного заряда сформировавшегося катиона пиридиния[5].
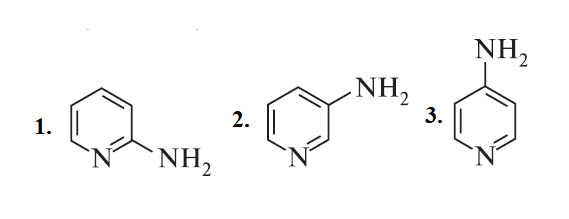
1. α-аминопиридин (2-аминопиридин, 2-пиридинамин)
2. β-аминопиридин (3-аминопиридин, 3-пиридинамин)
3. γ‑аминопиридин (4-аминопиридин, 4-пиридинамин)[5].
В молекуле β-аминопиридина аминогруппа с гетероатомом не сопряжена, поэтому солеобразование протекает по двум основным центрам[5].
α- и γ-аминопиримидины являются таутомерными веществами и могут существовать в двух таутомерных формах – аминной и иминной. Более устойчивой является аминная форма[5].
Реакционная способность аминопиридинов полностью зависит от положения аминогруппы в пиридиновом кольце[5].
β-аминопиридин отличают свойства характерные для ароматических аминов. По аминогруппе он способен вступать в реакции алкирования, ацилирования, диазотирования[5].
α- и γ-аминопиримидины в обычных условиях солей диазония образовать не могут, а с галогенами реагируют только по атому азота пиридинового кольца[5].
Аминопиридины вступают в реакции электрофильного замещения по пиридиновому кольцу (нитрование, галогенирование, сульфирование). Электирофильное замещение может происходить в орто- и параположении по отношению к аминогруппе[5].
Действие на вредные организмы
Аминопиридины могут обладать различной формой биологической активности.
Гербициды
Гербицидной активностью обладают соединения флуроксипир, пиклорам, аминопиралид[3].
В рамках классификации HRAC (Herbicide Resistance Action Comittee/Комитет по борьбе с устойчивостью к гербицидам) и WSSA (Weed Science Society of America/Американское научное общество по борьбе с сорняками) флуроксипир, пиклорам, аминопиралид рассматриваются в пределах класса пиридинкарбоксилаты (pyridyloxy-carboxylates)[6].
Механизм действия
. По классификации HRAC (Herbicide Resistance Action Comittee/Комитет по борьбе с устойчивостью к гербицидам) и WSSA (Weed Science Society of America/Американское научное общество по борьбе с сорняками) они относятся к группе auxin mimics (имитаторы ауксина, аналоги ауксина, синтетические ауксины) или группе 4. До 2020 года по HRAC данная группа обозначалась букво-кодом "О"[6].Подробнее о механизме действия веществ группы 4 (имитаторы ауксина) и их влиянии на расстения – в статьях "Феноксикарбоксилаты", «Пиридинкарбоксамиды».
Классы химических соединений, по механизму гербицидного действия – имитаторы (аналоги) ауксина (группа 4 (O) по классификации WSSA и HRAC):
- Бензоаты (benzoates);
- Пиридинкарбоксилаты (pyridine-carboxylates);
- Пиридилоксикарбоксилаты (pyridyloxy-carboxylates);
- Пиримидинкарбоксилаты (pyrimidine-carboxylates);
- Прочие (Other) - д.в. беназолин-этил;
- Хинолинкарбоксилаты (quinoline-carboxylates);
- Фенилкарбоксилаты (phenyl carboxylates);
- Феноксикарбоксилаты (phenoxy-carboxylates)[6].
Резистентность
. Зарегистрированы случаи возникновения резистентных биотопов сорных растений к гербицидам с действующими веществами относящимся к группе имитаторов ауксинов. Это ежовник обыкновенный, звездчатка средняя, куколь, пикульник (виды), ромашка непахучая, редька дикая, стрелолист монтевидейский, торица полевая, щирица Пауэлла, щирица Палмера[6].Профилактика резистентности
. В целях профилактики формирования биотопов устойчивых к веществам с ауксиноподобным действием необходимо соблюдать регламент их применения, а также исключить из чередования все препараты, включающие вещества такого же механизма действия[6].Химические классы, в пределах которых HRAC и WSSA рассматривают соединения с ауксиноподобным механизмом действия указаны в списке справа[6].
Репелленты
4-аминопиридин (γ‑аминопиридин) – авитрол, обладает репеллентной активностью и применяется для отпугивания птиц[3].
Применение
Аминопиридины применяют для изготовления различных лекарственных средств, красителей[2].
В сфере защиты растений аминопиридины выступают в качестве действующих веществ пестицидных препаратов. В частности, флуроксипир, пиклорам, аминопиролид разрешены к применению как действующее вещество гербицидов[1].
Токсикологические свойства и характеристики
Аминопиримидины – могут характеризоваться различной степенью опасности. Соединения, используемые как действующие вещества пестицидов, относятся к умеренно опасным веществам по отношению к человеку и малоопасные по отношению к пчелам[1].
Класс опасности
:- для человека – 3;
- для пчел – 3[1].
Получение
Аминопиридины получают следующими методами:
- из амидов кислот по реакции Гофмана (реакция первичного (незамещенного у азота) амида с гипобромитом натрия (или смесью NaОН+Вr2);
- β-аминопиридин получают: из нитросоединений восстановлением и из 3-бромпиридина путем воздействия аммиака при 140ºС в присутствии сульфата меди (CuSO4);
- α-аминопиридин – реакцией Чичибабина (путем реакции пиридина с амидом натрия)[4].
2. Кнунянц И. Л, Химическая энциклопедия: В 5 т.: АБЛ-ДАР/Редколлегия: Кнунянц И. Л. (гл. ред.) и др. – Москва: Издательство «Советская энциклопедия», 1988. – 625 стр.: ил.
3. Мельников Н.Н. Пестициды. Химия, технология и применение. - М.: Химия, 1987. 712 с.
4. Петров А.А., Бальян X.В., Трощенко А.Т. Органическая химия: Учебник для вузов. Под ред. Стадничука М. Д. — 5-е изд., перераб. и доп. — СПб: «Иван Федоров», 2002. — 624 с
5. Черных В. П., Зименковский Б. С., Гриценко И. С. Органическая химия: Учебник для студ. вузов / Под общ. ред. В. П. Ч ерных.— 2-е изд., испр. и доп.— Х .: Изд-во НФ аУ; Оригинал, 2007.— 776 с.