Химические классы пестицидов
Оглавление
- Физические и химические свойства
- Действие на вредные организмы
- Резистентность
- Профилактика резистентности
- Применение
- Токсикологические свойства и характеристики
Физические и химические свойства
Пиколиновая кислота (пиридин-2-карбоновая к-та) C6H5NO2 относится к карбоновым кислотам и производным пиридина (фото «Структурные формулы пиколиновой кислоты и ее изомеров» соединение 1). Это бесцветные кристаллы с температурой плавления 136–137°С. Пиколиновая кислота является изомером никотиновой (фото «Структурные формулы пиколиновой кислоты и ее изомеров» соединение 2) и изоникотиновой кислот (фото «Структурные формулы пиколиновой кислоты и ее изомеров» соединение 3)[4]. Подробнее – в статье "Пиридины".
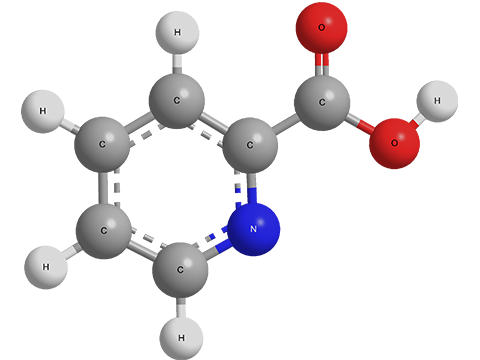
Пиколиновая кислота C6H5NO2 (номер CAS 98-98-6)[6]
Пиколиновая кислота действует как противоинфекционное средство и иммуномодулятор и вырабатывается организмом в количестве примерно 25–50 мг ежедневно путем расщепления триптофана. Играет ключевую роль в транспорте цинка. Является противовирусным средством in vitro и in vivo и иногда действует в сочетании с цитокинами, такими как гамма-интерферон, влияя на иммунные реакции. Обыкновенные угри, герпес и другие вирусные инфекции могут быть излечены при помощи лекарст, содержащих пиколиновую кислоту[7].
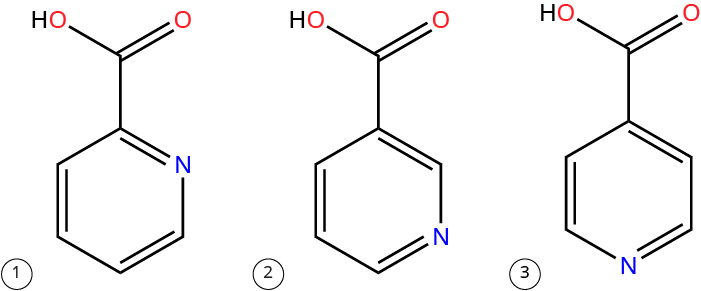
Структурные формулы пиколиновой кислоты и ее изомеров.
1. Пиколиновая кислота (номер CAS 98-98-6).
2. Никотиновая кислота (номер CAS 59-67-6).
3. Изоникотиновая кислота (номер CAS 55-22-1)[6].
Пиколиновая кислота хорошо растворима в воде и этаноле (5,44 г в 100 мл при 25°С), уксусной кислоте, нерастворима в диэтиловом эфире, бензоле, хлороформе. Образует соли с кислотами и основаниями[4].
В водных растворах существует в форме цвитриона, при нагревании до 180°С легко декарбоксилируется с образованием имидапиридиния[4].
При взаимодействии с алкилгалогенидами в щелочной среде пиколиновая кислота превращается в N- алкилпроизводные. По карбоксильной группе дает сложные эфиры, амиды, гидразиды и другие производные. Легко вступает в реакции нуклеофильного замещения. Длительное нагревание при 100°С с хлорангидридом сернистой кислоты (SOCl2) приводит к образованию 4-хлорпиколиновой кислоты, при более высокой темпратуре – к 4,6- и 4,5,6-хлорзамещенным. Восстановление пиколиновой кислоты дает раличные пиридиновые и пиперединовые производные[4].
Некоторые производные пиколиновой кислоты являются промежуточными продуктами в синтезе лекарственных средств. Например, 6-метилпиколиновая кислота – в синтезе димеколина[4].
Ag-соль пиколиновой кислоты – мягкий окислитель спиртов до альдегидов или кетонов, гидрохинонов до хинонов[4].
Классы химических соединений, по механизму гербицидного действия – имитаторы (аналоги) ауксина (группа 4 (O) по классификации WSSA и HRAC):
- бензоаты (benzoates);
- пиридинкарбоксилаты (pyridine-carboxylates);
- пиридилоксикарбоксилаты (pyridyloxy-carboxylates);
- пиримидинкарбоксилаты (pyrimidine-carboxylates);
- прочие (Other) – д.в. беназолин-этил (benazolin-ethyl);
- хинолинкарбоксилаты (quinoline-carboxylates);
- фенилкарбоксилаты (phenyl carboxylates);
- феноксикарбоксилаты (phenoxy-carboxylates)[8].
Действие на вредные организмы
Производные пиколиновой кислоты, как и сама пиколиновая кислота, являются биологически активными соединениями широкого спектра действия[6].
В сфере защиты растений чаще всего используют производные пиколиновой кислоты с гербицидными свойствами. В частности, Клопиралид (3,6-дихлорпиколиновая кислота). По классификации HRAC (Herbicide Resistance Action Comittee/Комитет по борьбе с устойчивостью к гербицидам) и WSSA (Weed Science Society of America/Американское научное общество по борьбе с сорняками) по механизму действия веществ с гербицидной активностью, он относится к auxin mimics (имитаторы ауксина, синтетические ауксины). Это группа 4 (по HRAC до 2020 г – группа O)[8].
Подробнее о механизме действия веществ группы 4 – в статьях "Пиридинкарбоксамиды", "Феноксикарбоксилаты".
Резистентность
. Производные пиколиновой кислоты с гербицидной активностью, как и все вещества группы 4 (аналоги (имитаторы) ауксина) относят к группе среднего риска по возможности возникновению резистентных биотопов[5]. Зафиксировано формирование резистентных биотопов у целого ряда видов сорных растений[8]. Подробнее – в статье «Клопиралид».Профилактика резистентности
:- соблюдение рекомендуемых регламентов применения гербицидов;
- исключение из чередования обработок препаратов с действующими веществами одного и того же механизма действия[5].
При применении производных пиколиновой кислоты, в частности клопиралида, из пользования следует исключить все вещества группы группа 4 (по классификации HRAC и WSSA ) – auxin mimics (имитаторы ауксина): бензоаты (benzoates); пиридинкарбоксилаты (pyridine-carboxylates); пиридилоксикарбоксилаты (pyridyloxy-carboxylates); пиримидинкарбоксилаты (pyrimidine-carboxylates); прочие (Other) – (беназолин-этил (benazolin-ethyl); хинолинкарбоксилаты (quinoline-carboxylates); фенилкарбоксилаты (phenyl carboxylates); феноксикарбоксилаты (phenoxy-carboxylates)[8].
Применение
Производные пиколиновой кислоты, в частности клопиралид, разрешены к использованию в качестве действующих веществ гербицидов для уничтожения однолетних и многолетних двудольных сорняков, в том числе устойчивых к 2,4-Д, главным образом из семейства сложноцветных и гречишных: ромашки, горцев, гречишки вьюнковой,осота полевого, бодяка полевого, латука татарского, одуванчика и др[1]. Относительно устойчивы к препарату: щирицы, марь белая и другие сорняки из семейства амарантовых[3].
Токсикологические свойства и характеристики
Производные пиколиновой кислоты имеют различные токсикологические свойства и характеристики. Используемый в качестве действующего вещества гербицидов клопиралид практически не разрушается в растениях, но в почве подвергается микробиологическому распаду с периодом полураспада в пределах 72 дней. Относится к малоопасным веществам (третий класс опасности для млекопитающих и для пчел)[3].
Подробнее – в статье «Клопиралид».
2. Джоуль Дж., Миллс К. Химия гетероциклических соединений. 2-е переработан. изд./ Пер. с англ. Ф. В. Зайцевой и А. В. Карчава. — М.: Мир, 2004. — 728 с., ил.
3. Дорожкина Л.А. Применение гербицидов и регуляторов роста в защите растений: учебное пособие / Л.А. Дорожкина, Л.М. Поддымкина. – М.: МЭСХ, 2021. – 206 с.
4. Кнунянц И. Л, Химическая энциклопедия: В 5 т.: т. 3: Меди-Полимерные / Редкол.: Кнунянц И. Л. (гл. ред.) и др. - М.: Большая Российская энциклопедия., 1992. - 639 стр.: ил.
5. Куликова Н.А, Лебедева Г.Ф. Гербициды и экологические аспекты их применения. Учебное пособие. – Москва, книжный дом «ЛИБРОКОМ», 2010. – 152с.
6. Тимощенко Л.В. Гетероциклические соединения: учебное пособие /Л. В. Тимощенко, Т. А. Сарычева; Томский политехнический университет. – Томск: Изд-во Томского политехнического университета, 2013 –90 с.
7. Pubchem.ncbi.nlm.nih.gov



