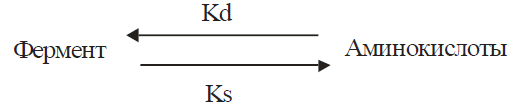Простые и сложные белки
Питание и дыхание всех микроорганизмов, в том числе бактерий, как физиолого-биохимические процессы осуществляются благодаря наличию в клетке различных ферментов. Микробные клетки, как и клетки высших организмов, оснащены достаточно активным ферментным аппаратом. Ферменты микроорганизмов обладают теми же свойствами и функциями, что и ферменты высших организмов.
На основании строения ферменты подразделяются на два больших класса: простые белки и сложные белки.
К простым белкам относятся гидролитические ферменты. Второй – более многочисленный класс, объединяет ферменты, управляющие окислением и катализирующие реакции переноса всевозможных химических групп.
Характерным признаком сложных белков является присутствие в строении небелковой группы (кофактора), определяющего активность фермента. Белковая часть сложного белка носит название – апофермент.
По отдельности белковая и небелковая часть таких соединений лишены ферментативной активности и приобретают ее только при соединении. Комплекс апофермента с кофактором носит название – «голофермент».
Классификация ферментов
Название фермента образуется от названия вещества, на которое он оказывает действие или вещества, связанного с природой катализируемой им химической реакции, путем прибавления окончания «- аза». Второй вариант является основой современной классификации и номенклатуры ферментов.
В настоящее время известно более двух тысяч ферментов. Они разделены на шесть классов, каждый из которых в свою очередь делится на соответствующие подклассы и подпод классы. Микроорганизмы, в том числе бактерии, располагают всем набором энзимов (ферментов). В микробной клетке одновременно могут находиться десятки различных ферментов.
Выделяют следующие классы ферментов:
- Оксидоредуктазы – окислительно-восстановительные ферменты, переносящие электроны. К ним относят дегидрогиназы, оксидазы, пероксидазы, каталазы.
- Трансферазы – переносят отдельные радикалы и атомы одних соединений к другим.
- Гидролазы – отвечают за ускорение реакций гидролиза (расщепления веществ на более простые с присоединением молекул воды. К ним относятся фосфатазы, эстеразы, глюкозидазы.
- Лиазы – катализаторы реакций присоединения групп по двойным связям и обратные реакции этих групп.
- Изомеразы – ферменты с помощью которых химические вещества преобразуются в их изомеры. К ним относят рацемазы, эпимеразы, цис-транс-изомразы.
- Лигазы (синтетазы) – катадизаторы реакций соединения двух молекул. К ним относятся глютаминсинтетаза, аспарагинсинтетаза.
Согласно современной классификации каждому ферменту присваивается шифр из четырех цифр. Первая обозначает класс, вторая – подкласс, третья – подподкласс, четвертая – порядковый номер фермента в данном подподклассе.
В частности карбамидамидогидролазе (уреазе) присвоен шифр КФ 3.5.1.5., поскольку она относится к третьему главному классу – гидролазы.
КоА синтетаза имеет шифр КФ 6.2.1.1, что обозначает, что данный фермент относится к шестому классу (лигазы, ко второму подклассу (образование С–связи) и к первому подподклассу (место образования связи в карбоксильной группе), последняя цифра – порядковый номер фермента.
Кроме того, ферменты в зависимости от реакции на условия среды делят на:
- конструктивные – концентрация в клетках микробов поддерживается независимо от условий среды на определенном уровне. К ним относятся ферменты гликолиза;
- индуцибельные – концентрация значительно увеличивается при наличии соответствующего субстрата. При отсутствии субстрата такие ферменты содержаться в клетке в очень малых количествах. К таким ферментам относятся β-галатозидаза, β- лактамаза;
- репресссибельные – энзимы, синтез которых блокируется конечным продуктом.
По связи с бактериальной клеткой различают:
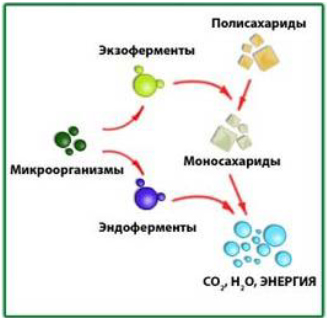
- экзоферменты – ферменты не связанные со структурой протоплазмы, легко выделяющиеся в субстрат (гидролитические ферменты), растворимые в питательной среде и проходящие через бактериальные фильтры. Экзоферменты участвуют в процессе питания, расщепляя сложные высокомолекулярные соединения (крахмал, белки, клетчатку) подготавливая питательные вещества к усвоению микробной клеткой.
- эндоферменты– ферменты прочно связанные с бактериальной клеткой и действующие только внутриклеточно. Они осуществляют дальнейшее разложение питательных веществ и превращают их в составные части клетки. К таким ферментам относятся дегидрогеназы и оксидазы.
Функции ферментов
В настоящее время установлено, что ферменты ускоряют химические реакции в организмах, путем понижения свободной энергии активации (количество энергии необходимое для перевода при данной температуре всех молекул одного моля вещества в активное состояние).
Все обменные процессы в клетках микроорганизмов идут с участием ферментов. Они являются биокатализаторами всех химических процессов бактериальной клетки. Данные соединения значительно ускоряют химические реакции. При этом они не расходуются и не входят в состав конечных продуктов.
Ферменты в клетках бактерий присутствуют в незначительных концентрациях, но все они обладают высокими числами оборачиваемости, которые указывают на возможность молекулы фермента катализировать следующие одна за другой реакции тысяч молекул субстрата в минуту.
Установлено, что каждый фермент катализирует только одну реакцию, что обусловливает его специфичность. Обменные процессы микробов протекают с помощью ферментов, набор которых генетически детерминирован и специфичен для каждого вида.
В то же время количество того или иного фермента, содержащееся в бактериальной клетке изменчиво. Приспосабливаемость бактерий к изменяющимся условиям среды обитания сопровождается согласованными изменениями процессов анаболизма и катаболизма. Поскольку регуляция обменных процессов осуществляется с помощью ферментов, то и регуляторные (амфиболические) ферменты воспринимают разнообразные метаболические сигналы и в соответствии с ними изменяют свою каталитическую активность. Выделяют три уровня регуляции ферментативных реакций с учетом потребности клеток в энергии:
- первый – изменение абсолютного количества фермента;
- второй – изменение фона реагирующих веществ, исключая фермент;
- третий – изменение каталитической активности фермента.
Абсолютное количество определенного фермента определяется скоростью его синтеза (Ks) и скоростью распада (Kd) по схеме, приведенной на фото 2.
Количество фермента увеличивается за счет возрастания Ksили уменьшения Kd или уменьшается при соответствующем соотношении данных процессов.
Изменение каталитической активности фермента вызывается:
- ингибированием каталитической активности фермента по типу обратной связи (торможение активности фермента в начале биосинтетического пути конечным продуктом);
- аллостерической активацией (конечный и промежуточный продукт активирует другой, включающий синтез нового вещества);
- воздействием регуляторных белков, которые присоединяются к ферменту, изменяя (усиливая или ослабляя) его активность.
Изменение ферментативной активности микроорганизмов, в том числе бактерий, положено в основу фенотипической идентификации (фенотипические критерии систематики). Для использования спектра ферментов у прокариот используются дифференциально-диагностические питательные среды.
Оптимальные условия действия ферментов
Активность ферментов в большей степени зависит от температуры и величины рН.
Установлено, что оптимальная температура действия ферментов: + 40°C–+ 50°C. Для некоторых +58°C–+60°C. При температуре + 100°Cферменты разрушаются.
Максимальная активность ферментов бактерий, растущих в кислой среде (ацидофилы), наблюдается при рН 4,8. В нейтральной или близкой к нейтральной – при рН 7,2. Однако у бактерий способных расти в широком диапазоне рН, данный показатель практически не влияет на активность ферментов.